
2020年以來,GB9706.1-2020及配套并列標準、專用標準陸續(xù)發(fā)布,并于2023年5月1日起正式實施;作為醫(yī)用電氣設備的基礎標準,該系列標準的實施對保障醫(yī)療器械安全、促進產(chǎn)業(yè)高質量發(fā)展意義重大。
GB 9706.1-2020及配套并列、專用標準信息表
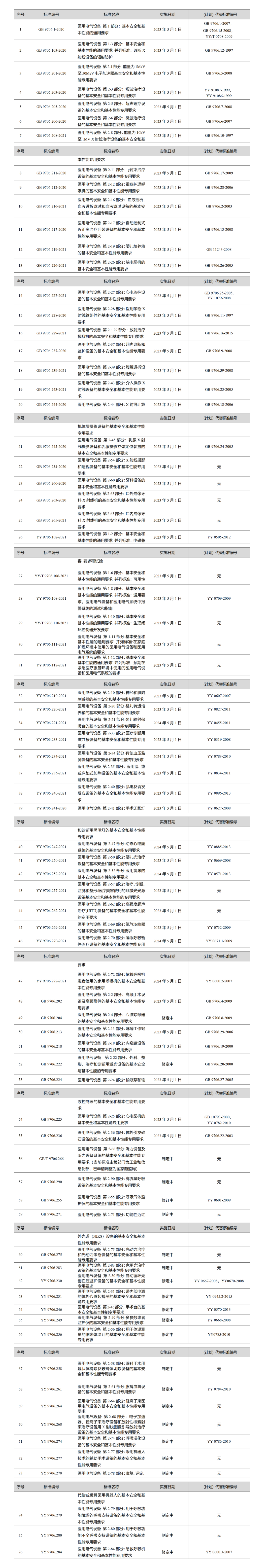
三、GB9706.1 新舊標準有什么重大變化?
第一章總則的第七條明確規(guī)定:醫(yī)療器械產(chǎn)品應當符合醫(yī)療器械強制性國家標準;尚無強制性國家標準的,應當符合醫(yī)療器械強制性行業(yè)標準。
《關于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(2021年第121號)中要求:
免責聲明
- 凡本網(wǎng)注明“來源:儀器網(wǎng)”的所有作品,均為浙江興旺寶明通網(wǎng)絡有限公司-儀器網(wǎng)合法擁有版權或有權使用的作品,未經(jīng)本網(wǎng)授權不得轉載、摘編或利用其它方式使用上述作品。已經(jīng)本網(wǎng)授權使用作品的,應在授權范圍內使用,并注明“來源:儀器網(wǎng)”。違反上述聲明者,本網(wǎng)將追究其相關法律責任。
- 本網(wǎng)轉載并注明自其他來源(非儀器網(wǎng))的作品,目的在于傳遞更多信息,并不代表本網(wǎng)贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網(wǎng)站或個人從本網(wǎng)轉載時,必須保留本網(wǎng)注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發(fā)表之日起一周內與本網(wǎng)聯(lián)系,否則視為放棄相關權利。
 移動端
移動端






 回放
回放
 回放
回放







 浙公網(wǎng)安備 33010602002722號
浙公網(wǎng)安備 33010602002722號